Le taro au secours de la forêt marécageuse à mangle médaille de Guadeloupe
Amadou Bâ
Le mangle médaille (Pterocarpus officinalis) est un arbre endémique de la région Caraïbe, essentiel aux forêts marécageuses. L'expansion de l'agriculture et le développement urbain réduisent progressivement l'étendue des peuplements de mangles médailles. Et si la solution à la menace qui pèse sur cet arbre venait d'un autre trésor de la nature, le taro (madère) ?

I. Introduction
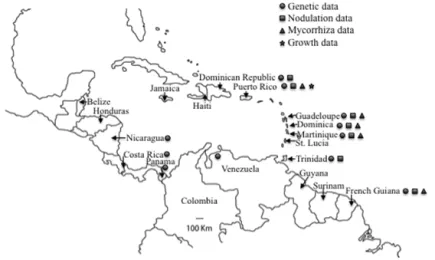
Dans la région Caraïbe (îles et continent), la forêt marécageuse à mangle médaille, connu sous son nom scientifique, Pterocarpus officinalis Jacq., est une formation remarquable qui se développe sur des sols inondés ou temporairement inondés en arrière de la mangrove, le long des cours d’eau à l’intérieur des terres et dans des dépressions humides en montagne (Figure 1 ; Bâ & Rivera-Ocasio 2015). Elle est présente dans l’arc des Antilles, sur l’île de Porto Rico, en République Dominicaine, tout comme dans le Sud du Mexique, en Amérique Centrale (Belize, Costa Rica, Honduras, Nicaragua, Panama) et dans toute la partie Nord de l’Amérique du Sud (ex. Colombie, Guyane française, Surinam, Venezuela) (Rivera-Ocasio et al. 2002 ; Bâ & Rivera-Ocasio 2015). La forêt marécageuse à mangle médaille couvre plus de 167 ha à Porto Rico et environ 15 ha dans la forêt marécageuse du Galion en Martinique (Figure 2) (Bâ & Rivera-Ocasio 2015). En Guadeloupe, elle couvre environ 2600 ha dont 460 ha dans la réserve naturelle du Grand-Cul-de-sac Marin qui fait l’objet d’un statut de protection (Imbert et al. 2000). Elle fournit de multiples services écosystémiques tels que l’habitat de nombreuses espèces endémiques de plantes et d'animaux, et la réduction de l'érosion du sol le long des marges et des berges des rivières dans les zones côtières (Bâ & Rivera-Ocasio 2015). Malgré leur intérêt écologique, l'expansion de l'agriculture et le développement urbain réduisent l'étendue des peuplements de mangles médailles (Figure 3). L’espèce P. officinalis inscrite sur la liste rouge des espèces menacées selon l’UICN (Barstow & Klitgård 2018).
Figure 2

Figure 3

L’espèce P. officinalis est endémique de la région Caraïbe et peut représenter jusqu’à 90 % de la strate arborée des forêts marécageuses (Imbert et al. 2000 ; Bâ & Rivera-Ocasio 2015). Ses noms vernaculaires sont souvent en relation avec son latex rouge sang : « mangle sang » (créole guadeloupéen), « mangle médaille » (Guadeloupe, Martinique), « moutouchi rivière » (Guyane), « bloodwood » « Sangre de drago » et « Palo de pollo », (pays hispanophones) (Muller 2006). Le latex rouge sang, exsudé au niveau de coupes et blessures diverses, a des propriétés pharmacologiques, favorisant la cicatrisation des plaies et les soins des boutons de fièvre d’origine herpétique (Bacon 1990). Sa gomme sang dragon a le pouvoir de resserrer les tissus vivants et d'arrêter les hémorragies. (Bonhême et al. 1998). Son bois blanc à nervure rouge sang est utilisé pour son esthétique dans l’artisanat par les Saramacas de Guyane, un peuple bushinengué descendant d’esclaves fugitifs d’ascendance africaine. Ce bois a été exploité en Guadeloupe comme bois de feu, en particulier dans les fours à chaux pour alimenter les distilleries jusqu’au milieu du siècle (Alvarez-Lopez 1990). Le mangle médaille peut atteindre 40 m de haut à maturité pour un diamètre de 60 à 90 cm à sa base (Muller 2006).
II. Des symbioses végétales utiles à la réhabilitation des forêts marécageuses à mangle médaille
Comme la plupart des légumineuses (Fabaceae), le mangle médaille P. officinalis établit une double symbiose :
- avec des bactéries (genre Bradyrhizobium) pour s’alimenter en azote grâce à la fixation biologique de l’azote de l’air (N2)
- avec des champignons (champignons mycorhiziens à arbuscules) pour s’alimenter en phosphore du sol
De ces symbioses naissent respectivement des nodules et des mycorhizes à arbuscules (Bâ et al. 2004 ; Saint Etienne et al. 2006 ; Fougnies et al. 2007). Les nodules et les arbuscules sont les lieux d’échanges bidirectionnels entre les partenaires : la plante fournit des sucres aux champignons et bactéries qui, en retour, l’alimentent respectivement en phosphore et en azote. Grâce à sa double symbiose, le mangle médaille peut s’adapter à la salinité, à l’inondation et à la carence en phosphore et azote des sols marécageux (Figure 3) (Saint Etienne et al. 2006 ; Fougnies et al. 2007 ; Dulormne et al. 2010 ; Fall et al. 2024).
Le choix des partenaires de la symbiose, c’est-à-dire les mangles médailles, les bactéries et les champignons, est un aspect important à prendre en compte dans des programmes de réhabilitation des forêts marécageuses. La diversité génétique du mangle médaille P. officinalis est plus élevée dans les populations guyanaises continentales que dans les populations caribéennes insulaires (Rivera-Ocasio et al. 2002 ; Muller et al. 2006 ; Muller et al. 2009). Il en va de même de la diversité génétique des bactéries insulaires comparées à la diversité observée en milieu continental (Guyane française) (Le Roux et al. 2012). De plus, les bactéries insulaires n’ont pas de préférence de partenaires dans la mesure où elles nodulent avec toutes les provenances de P. officinalis quelle que soit leur origine géographique (Le Roux et al. 2012). Pourtant, les associations homologues P. officinalis-bactérie de la même origine géographique sont plus efficaces en termes de nodulation, d’acquisition d’azote foliaire et de production de biomasse que les associations hétérologues d’origine géographique différente (Le Roux et al. 2012). La plus grande efficacité des associations homologues serait due à une coévolution P. officinalis-bactérie et devrait être donc pris en considération dans le choix des partenaires dans les programmes de réhabilitation des forêts marécageuses dégradées.
Figure 4

III. Un système agroforestier traditionnel inédit à préserver
En Guadeloupe, les paysans cultivent délibérément du taro, connu localement sous le nom de madère (nom scientifique : Colocasia esculenta), à l’ombre des peuplements de mangles médailles en forêt marécageuse (Figure 5). Le taro de la famille des Aracées, est un légume racine cultivé pour ses tubercules (cormes) riches en amidon très digeste. Les tubercules et les feuilles participent à l’alimentation de base des populations. En Martinique, on l’appelle le dachine ou le chou de chine ; en Guyane, c’est le tayove ; en Polynésie, ils consomment du kalo, tandis qu’à la Réunion, c’est le songe.
La culture du taro en sous-bois des mangles médailles se distingue par l'absence d'utilisation d'engrais et de pesticides, contrairement aux pratiques en prairie. Ce système agroforestier offre de nombreux avantages. Il préserve la biodiversité floristique, faunistique et microbienne des forêts de mangle médaille, tout en créant un microclimat favorable au développement du taro, grâce à une régulation de l'humidité et de la température. Par ailleurs, les contreforts et les racines des mangles médailles contribuent à la stabilisation des sols tourbeux, réduisant ainsi les risques d'érosion. Ce mode de culture garantit également des concentrations extrêmement faibles en résidus d’intrants agricoles dans les tubercules, assurant une production plus saine. Enfin, cette approche durable répond à une demande sociétale croissante, s'inscrivant parfaitement dans le contexte guadeloupéen.
La fixation biologique de l’azote atmosphérique par le mangle médaille constitue probablement la principale source d’azote dans le système agroforestier qui l’associe au taro (Fall et al. 2024). Cet azote fixé peut-être transféré au taro par trois mécanismes non exclusifs : (i) un transfert direct des racines du mangle médaille aux racines du taro, (ii) un transfert indirect après décomposition des tissus du mangle médaille (tiges, racines et nodules) et minéralisation de leurs composés azotés, et (iii) un transfert indirect à travers les réseaux mycorhiziens, formés par les filaments des champignons mycorhiziens à arbuscules reliant les racines du mangle médaille à celles du taro (Geoffroy et al. 2017). On estime qu’il y a environ 27% de l’azote fixé transféré du mangle médaille au taro en forêts marécageuses et que ce transfert pourrait se faire via les filaments des champignons reliant les racines du mangle médaille à celles du taro (Fall et al. 2024). En effet, en conditions contrôlées, il y a environ 18% de l’azote fixé transféré du mangle médaille au taro via les filaments du champignon Rhizophagus irregularis IR27 (Fall et al. 2024).
Figure 5

Le système agroforestier associant le mangle médaille au taro, permet le transfert de l’azote fixé de l’arbre au bénéfice du légume racine en partie par l’intermédiaire des champignons communs aux deux plantes. Ce système agroforestier contribuerait aussi à un apport substantiel d'azote dans le sol, améliorant ainsi la fertilité des sols et donc les rendements en tubercules de taro. Cette pratique agroforestière constitue une alternative prometteuse aux intrants chimiques tels que les engrais et les pesticides, offrant une approche durable pour la gestion des terres et la préservation des écosystèmes en Guadeloupe et dans la région Caraïbes.
IV. Bibliographie
- Alvarez-Lopez M (1990) Ecology of Pterocarpus officinalis forested wetlands in Puerto Rico. In: Lugo AE, Brinson M, Brown S (eds) Ecosystems in the world 15 forested wetlands. Elsevier, Amsterdam, pp 251–265
- Bâ AM, Samba R, Sylla SN, Le Roux C, Neyra M, Rousteau A, Imbert D & Toribio A (2004) Characterization of the diversity of symbiotic microorganisms in Pterocarpus officinalis in swamp forests of Guadeloupe and Martinique. Revue d’Ecologie (Terre et Vie) 59:163-170
- Bâ AM & Rivera-Ocasio E (2015) Genetic diversity and functional traits of Pterocarpus officinalis Jacq. associated with symbiotic microbial communities in Caribbean swamp forests in relation to insular distribution, salinity and flooding. Wetlands 35 (3):433–442. https://doi.org/10. 1007/s13157-015-0651-5
- Bacon (1990) Ecology and management swamp forest in the Guianas and Caribbean region. Ecosyst World 15:213–250
- Barstow M & Klitgård BB (2018) Pterocarpus officinalis. The IUCN Red List of Threatened Species. https://dx.doi.org/10.2305/IUCN.UK.2018-2.RLTS.T62027812A62027814.en
- Bonhême I, Imbert D, Rousteau A, Saur E (1998) La forêt marécageuse à Pterocarpus officinalis. Sa situation en Guadeloupe. Bois Forêt Trop 258:59–68
- Dulormne M, Musseau O, Muller F, Toribio A & Bâ AM (2010) Effects of NaCl on growth, water status, N2 fixation, and ion distribution in Pterocarpus officinalis seedlings. Plant & Soil 327:23-34 DOI: 10.1007/s11104-009-0066-2
- Fall F, Galiana A, Pruneau L, Roux-Cuvelier M & Bâ AM (2024) Corrections: Belowground nitrogen transfer from Pterocarpus officinalis to Taro under field and controlled conditions Plant Soil https://doi.org/10.1007/s11104-024-06734-3
- Fougnies L, Renciot S, Muller F, Plenchette C, Prin Y, de Faria SM, Bouvet JM, Sylla SNd, Dreyfus B & Bâ AM (2007) Arbuscular mycorrhizal colonization and nodulation improve flooding tolerance in Pterocarpus officinalis Jacq. seedlings. Mycorrhiza 17:159-166 DOI: 10.1007/s00572-006-0085-2
- Geoffroy A, Sanguin H, Galiana A & Bâ AM (2017). Molecular characterization of arbuscular mycorrhizal fungi in an agroforestry system reveals the predominance of Funneliformis spp. associated with Colocasia esculenta and Pterocarpus officinalis adult trees and seedlings. Frontiers in Microbiology 8:1426-1429. https://doi.org/10.3389/fmicb.2017.01426
- Imbert D, Bonhême I, Saur E & Bouchon C (2000) Floristics and structure of the Pterocarpus officinalis swamp forest in Guadeloupe, Lesser Antilles. Journal of Tropical Ecology 16:55-68.
- Le Roux C, Muller F, Bouvet JM, Dreyfus B, Béna G, Galiana A & Bâ AM (2014) Genetic diversity patterns and functional traits of Bradyrhizobium strains associated with Pterocarpus officinalis Jacq. In Caribbean islands and amazonian forest (French Guiana). Microbial Ecology 68:329–338. https://doi.org/10.1007/s00248-014-0392-7
- Muller F (2006) Diversité génétique, adaptation de Pterocarpus officinalis (Jacq.) et de ses symbiotes dans des forêts marécageuses de la région Caraïbe. Ph.D thesis Antilles-Guyane University, France
- Muller F, Vaillant A, Bâ AM & Bouvet JM (2006) Isolation and characterization of microsatellite markers in Pterocarpus officinalis Jacq. Molecular Ecology Notes 6: 462-464 https://doi.org/10.1111/j.1471-8286.2006.01273.x
- Muller F, Voccia M, Bâ AM & Bouvet JM (2009). Genetic diversity and gene flow in a Caribbean tree Pterocarpus officinalis Jacq.: a study based on chloroplast and nuclear microsatellites. Genetica 135 : 185-198 DOI: 10.1007/s10709-008-9268-4
- Rivera-Ocasio E, Aide TM & McMillan WO (2002) Patterns of genetic diversity and biogeographical history of the tropical wetland tree, Pterocarpus officinalis (Jacq.) in the Caribbean basin. Molecular Ecology 11:675–683
- Saint-Etienne L, Paul S, Imbert D, Dulormne M, Muller F, Torobio A, Plenchette C & Bâ AM (2006) Arbuscular mycorrhizal soil infectivity in a stand of the wetland tree Pterocarpus officinalis along a salinity gradient. Forest Ecology and Management 232:86-89 https://doi.org/10.1016/j.foreco.2006.05.046
- Saur É & Imbert D (2003) Traditional Taro monoculture under the swamp forest of Guadeloupe. Bois Trop 277(3):85–89
Disponibles sur Manioc :
Livres
- Duss, Antoine, Flore phanérogamique des Antilles françaises : Martinique et Guadeloupe, Mâcon, Protat frères, 1897. http://www.manioc.org/patrimon/SCH13269.
- Lanessan, Jean-Louis de, Les plantes utiles des colonies françaises, Ministère de la marine et des colonies, 1886. http://www.manioc.org/patrimon/FCL18019.
- Sagot, Paul Antoine, « Des tayes ou tayoves », extrait de Journal de la société centrale d'horticulture de France, Paris, Imprimerie de E. Donnaud, 1871. p. 506-514. http://www.manioc.org/patrimon/FRA11227-7.
Images
- « Moutouchi Suberosa », planche en taille-douce extraite de l’Histoire des plantes de la Guiane françoise,Tome IV, planche 299, Londres, P.-F. Didot jeune, 1775. http://www.manioc.org/images/FRA110570221i1.
Citer cet article
Copier les références de l’article